Pourquoi de nombreux médicaments testés sur des animaux échouent-ils dans les essais cliniques ?

Les essais cliniques garantissent que les patients humains et animaux reçoivent des médicaments aussi sûrs que possible. Aucun médicament ne peut être sûr à 100%, c'est-à-dire ne pas avoir d'effets secondaires du tout. C'est pourquoi les tests sur les animaux et les humains sont si stricts, afin de développer des médicaments qui sont aussi efficaces que possible et qui ont le moins d'effets secondaires possible.
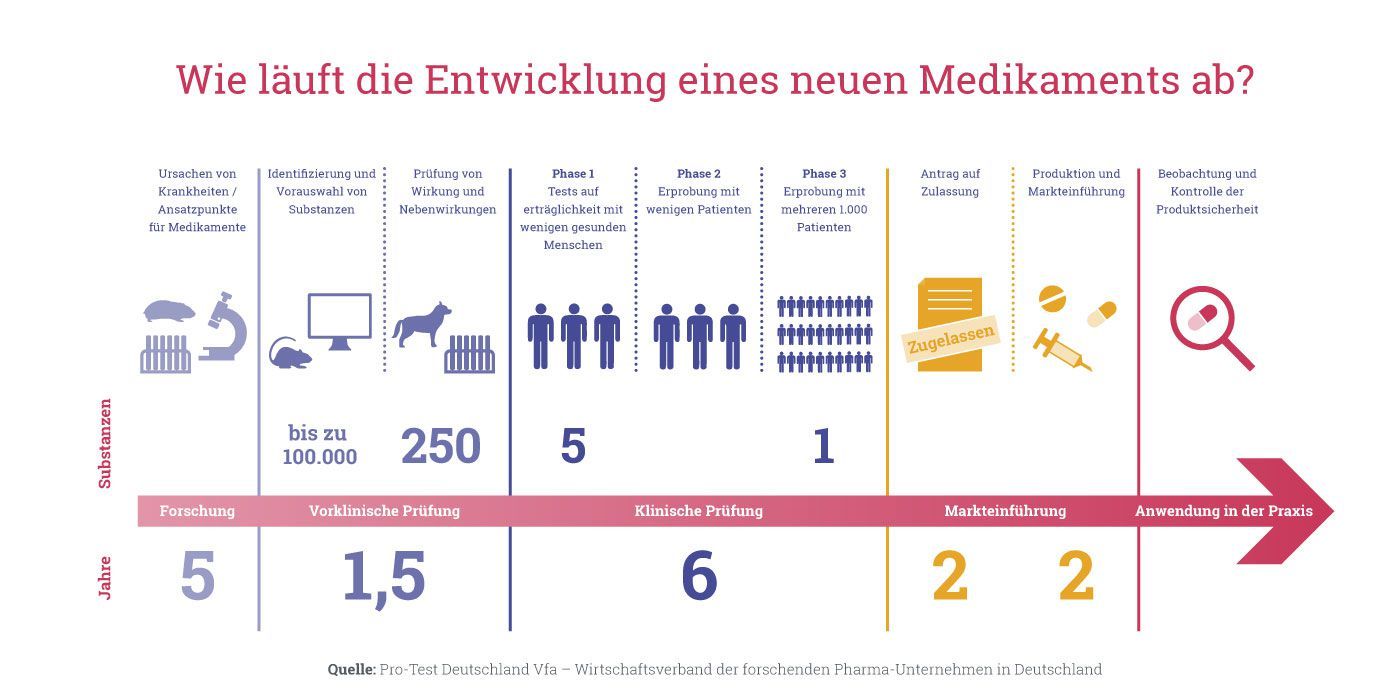
Pour cela, il faut comprendre comment se déroulent ces tests de médicaments : Pour qu'une nouvelle substance active soit autorisée en tant que médicament et mise sur le marché, elle doit passer par différentes phases de test. Dans un premier temps, seuls des tests sur des cultures cellulaires et sur des animaux de laboratoire sont effectués. Si elles sont concluantes, elles sont d'abord testées sur un petit nombre d'humains seulement, puis - si l'utilité est jugée importante et le risque faible - progressivement sur un nombre croissant de personnes.
Dans les tests de sécurité précliniques (c'est-à-dire dans les études sur les animaux), environ un tiers des médicaments expérimentaux échouent déjà, car ils se révèlent inefficaces ou trop dangereux. De nombreuses substances échouent ensuite dans les phases ultérieures des études cliniques pour différentes raisons. Si une préparation n'est pas mise sur le marché, c'est donc souvent parce qu'elle a été jugée trop dangereuse pour l'homme lors d'études sur des cultures cellulaires ou d'essais sur des animaux. Cela signifie la fin du développement d'une préparation.
Les phases prescrites par les autorités sont décrites ici en détail ; le développement d'un médicament dépend de la réussite de chaque phase :
Phase préclinique
On étudie l'effet d'une substance sur des cultures de cellules ou de tissus. S'il existe des preuves fiables que la substance est théoriquement efficace dans un organisme, des tests sont réalisés sur des animaux. On commence d'abord par de petites études avec très peu d'animaux. Les questions auxquelles on y répond sont les suivantes : "Y a-t-il un bénéfice thérapeutique potentiel ?", "La préparation est-elle suffisamment sûre pour être utilisée en phase I chez l'homme ?". En outre, des études sur la dose, l'effet et la distribution dans le corps (pharmacologie et pharmacocinétique) sont réalisées chez l'animal. Au cours du développement préclinique suivant, d'autres expériences sur les animaux visent également à tester la tolérance (tests de toxicité) et à exclure, par exemple, les malformations chez les fœtus. La plupart de ces études précliniques sur les animaux sont imposées, en ce qui concerne leur taille et les questions posées, par des directives réglementaires de Swissmedic ou de la Food and Drug Agency FDA américaine. Les résultats sont examinés par les autorités de réglementation et les essais cliniques chez l'homme ne sont autorisés qu'avec l'accord de ces autorités. Une entreprise pharmaceutique doit donc effectuer des tests sur les animaux si elle souhaite mettre un médicament sur le marché, car sinon elle n'obtiendrait pas l'autorisation de procéder à des tests cliniques de substances chez l'homme.
Phase I
Il s'agit de la première étude sur l'homme. Cette phase ne peut être lancée que si les résultats des tests préalables sur les animaux sont positifs et que la substance est considérée comme suffisamment sûre pour oser un premier test sur l'homme. Seules quelques personnes sont soumises à des conditions strictes et à une surveillance rigoureuse pour tester si une substance active apporte un succès thérapeutique ou si elle est également sûre chez l'homme. Cette tolérance est généralement étudiée sur six à dix volontaires sains ou sur des patients gravement malades qui ne disposent d'aucune autre option de traitement. Les questions auxquelles les chercheurs veulent répondre lors de la phase I sont les suivantes : "Quels sont les effets de la substance active chez l'homme ?", "Quels sont les effets secondaires ?", "Un médicament est-il suffisamment sûr pour être étudié sur un groupe plus important de patients ?".
Phase II
Si la phase I apporte suffisamment d’indices que le médicament présente un avantage et ne pose pas de problèmes de sécurité, la substance active peut continuer d’être examinée dans la phase clinique II. Elle est testée cette fois sur un petit nombre de patients sélectionnés à cette fin. Suivant le type de maladie contre laquelle la substance active est utilisée, l’essai de phase II est effectué sur 20 à 300 sujets. L’intérêt porte ici sur des questions telles que : « le succès du traitement dépend-il de la dose ? » ou « Quel est le schéma thérapeutique le plus efficace ? ».
Dans cette phase aussi, des essais parallèles ont lieu sur l’animal, pour tester l’effet du médicament sur la reproduction.
Phase III
Si les résultats des phases I et II sont encourageants, on passe à la phase clinique III, au cours de laquelle un nouveau médicament est étudié encore plus en détail sur un grand groupe de patients dans des conditions proches de la pratique médicale envisagée. L’étude porte cette fois sur 300 à 3000 sujets ou davantage. Elle porte avant tout sur des aspects tels que : « La sécurité et l’efficacité de la nouvelle préparation sont-elles meilleures, moins bonnes ou égales à celles de traitement établis comparables ? », « Comment la substance active examinée se comporte-t-elle en combinaisons avec d’autres médicaments ? » ou « Comment prescrire le médicament de façon optimale au patient ? ».
Pendant la phase III aussi, des essais parallèles sur l’animal ont lieu pour exclure autant que possible un effet cancérigène après une prescription de longue durée.
Phase IV
Une fois la phase III terminée avec succès, le médicament peut être autorisé à être prescrit. Cependant, il est encore surveillé dans le cadre d’études cliniques de phase IV, pour déceler et évaluer d’éventuels effets secondaires. Dans la pratique médicale quotidienne, un grand nombre de patientes et de patients prennent le médicament, ce qui permet d’acquérir beaucoup de données sur son efficacité et son action à long terme. Il est ainsi possible également d’identifier des effets secondaires rares ou très rares.